我院放射科团队联合侯宇教授在《Molecular Therapy》发表重磅综述:系统揭示肿瘤外泌体驱动转移的机制与诊疗新策略
近日,我院放射科团队与基础医学院侯宇教授团队在Cell Press旗下国际顶级期刊《Molecular Therapy》(影响因子:12.4)合作发表了题为“Unveiling New Insights into Extracellular Vesicles in Metastatic Cancer: A Journey from Mechanisms to Diagnostics and Targeted Therapies”的长篇综述论文。该论文系统阐述了肿瘤来源细胞外囊泡(TDEs)在癌症转移中的核心作用及其临床转化前景,为癌症精准诊疗提供了全新思路。放射科刘丹副教授与侯宇教授为本文共同通讯作者。
聚焦关键机制:绘制“四维网络图”
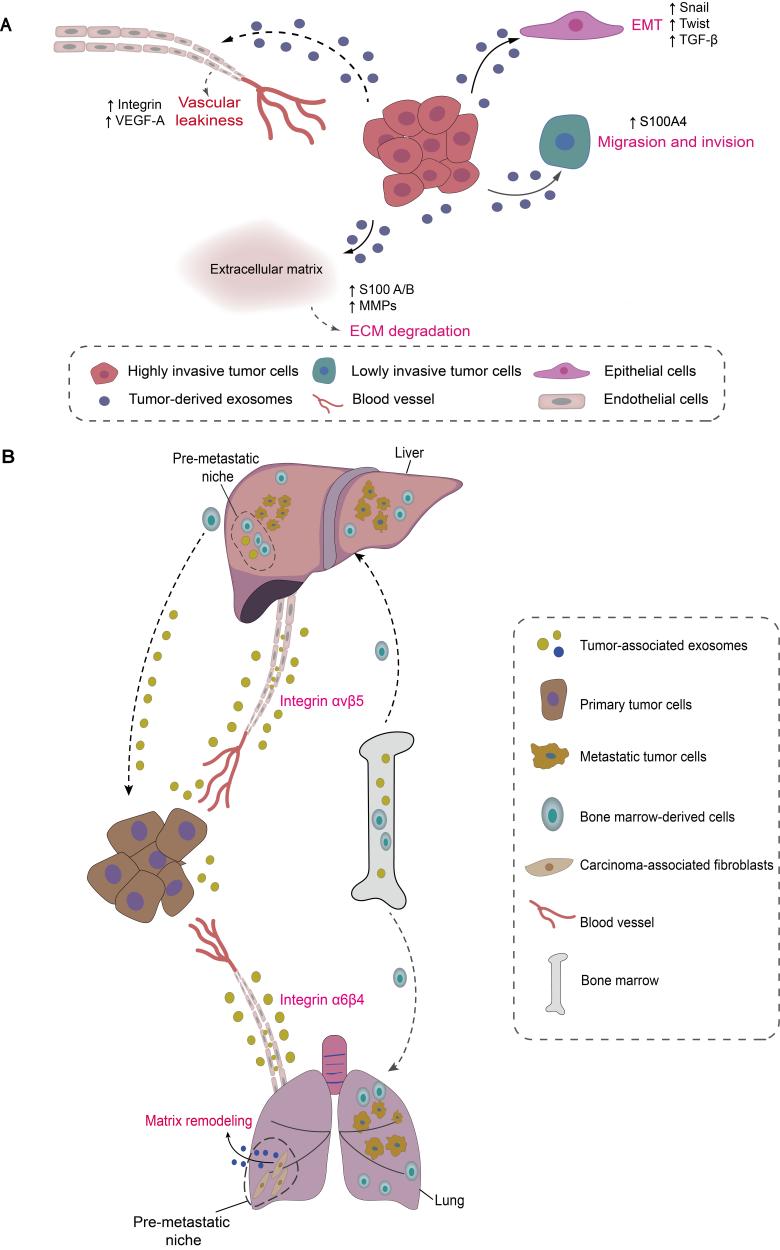
肿瘤外泌体(TDEs)是肿瘤细胞分泌的纳米级囊泡(30–150nm),携带母细胞特异的生物活性物质(蛋白质、核酸、脂质、代谢物),能穿越血脑屏障等生理屏障,在细胞间充当“信号信使”,重塑局部及远处微环境,被誉为癌症转移的“远程指挥车”。该综述创新性地提出了肿瘤外泌体驱动转移的“四维网络图”机制框架:
基质重塑: TDEs携带蛋白酶(如MMPs)降解细胞外基质(ECM),为肿瘤细胞侵袭开路。
表型转化: TDEs传递信号分子(如TGF-β, Wnt)诱导上皮-间质转化(EMT),增强肿瘤细胞迁移能力。
血管渗漏: TDEs作用于内皮细胞,增加血管通透性,促进肿瘤细胞外渗。
预制“土壤”: TDEs远程“教育”远处器官基质细胞,创建利于肿瘤细胞定植的“转移前微环境”(PMN),实现器官趋向性转移。
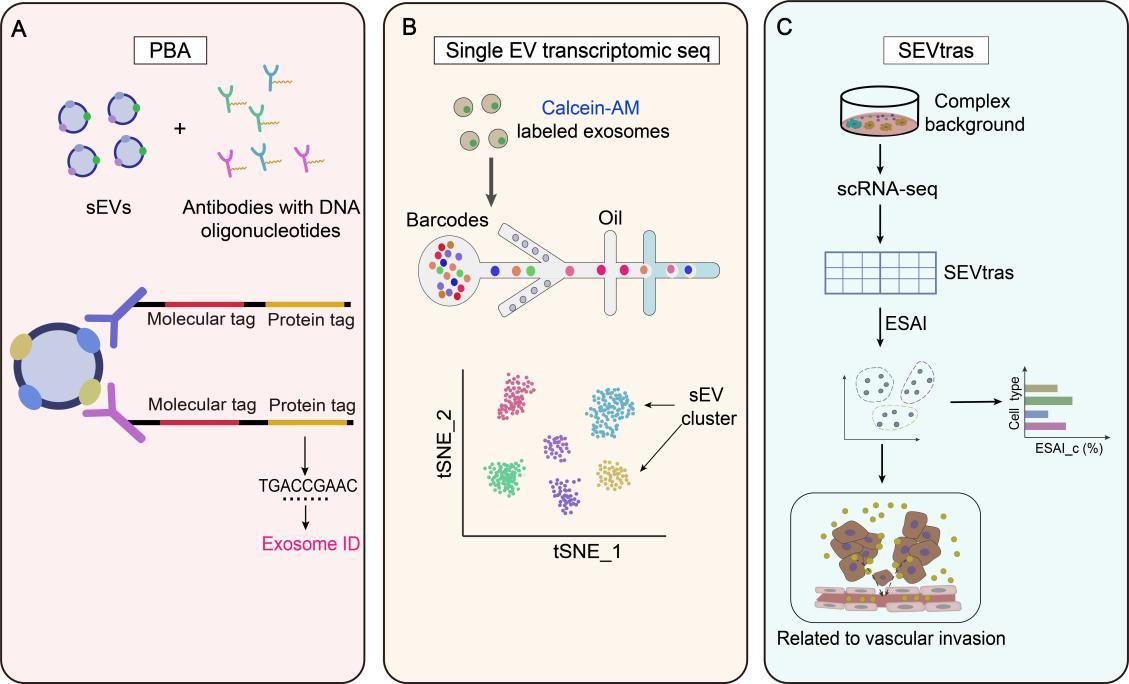
破解技术难题:单囊泡多组学分析
针对肿瘤异质性带来的TDEs研究挑战,团队重点归纳并评述了前沿的单囊泡水平多组学分析技术(如PBA、SEVtras)。这些技术能够一次性解析单个外泌体携带的蛋白质、RNA和DNA信息,极大地提升了从复杂体液样本中识别疾病特异性外泌体亚群和标志物的能力,为精准诊断奠定技术基础。
构建诊疗闭环:从预警到干预
基于对机制的深入理解和技术突破,综述开创性地构建了一条“机制-诊断-治疗”的快速转化路径:
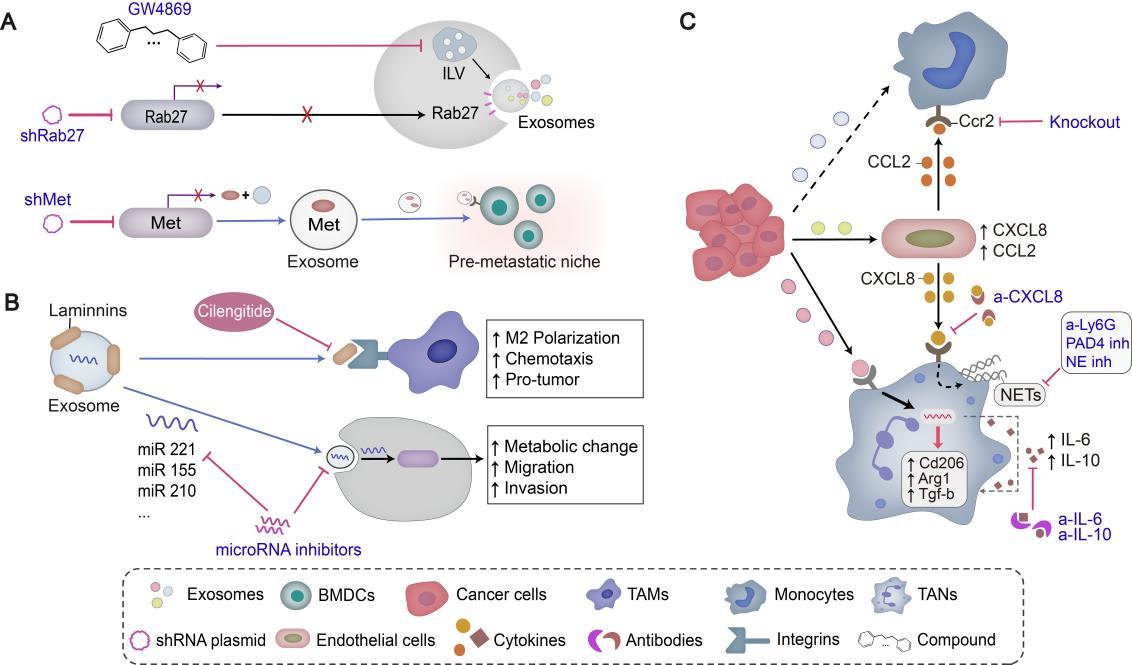
一、早期预警诊断: 利用血液等体液样本,通过检测TDEs表面特异性整合素(如α6β4预测肝转移、αvβ5预测肺转移),可提前锁定高转移风险患者。
二、靶向精准干预:归纳了三大靶向策略:1.抑制TDEs生成(如靶向Rab27a,药物GW4869);2.阻断其器官趋向信号;3.重塑免疫抑制微环境。文中盘点了4项已进入I期临床试验的EV靶向疗法,并强调了利用工程化外泌体作为高效载体,递送siRNA或化疗药物进行靶向治疗的巨大潜力。
三、动态疗效监测:治疗期间,通过液体活检追踪TDEs中动态变化的生物标志物(如PD-L1、miR-21),可实时评估免疫治疗应答及耐药性,指导用药方案调整。
实现核心成果
本研究系统梳理并整合了近年来TDEs在转移领域的关键发现,其核心成果体现在:清晰绘制了TDEs介导转移的“四维网络图”,为理解转移级联反应提供了整合视角。总结了单囊泡多组学技术,为解决肿瘤异质性和实现高灵敏度诊断提供了方案。推动临床转化:整合了从风险预警(整合素标志物)、靶向治疗(三大策略、工程化载体)到疗效监测(动态标志物)的全流程闭环管理策略,加速了TDEs研究成果向临床应用的落地。
展望未来方向
基于本次综述奠定的理论基础,团队明确了下一步的核心目标:一、深化跨学科协作:刘丹副教授将与基础医学院侯宇教授团队进一步加强紧密合作,整合优势资源,力争在该前沿领域取得更大突破性成果。二、加速临床转化应用,全力推动研究成果向临床治疗成果转化。
刘丹副教授和侯宇教授为本文的共同通讯作者。本研究得到了国家自然科学基金、重庆市自然科学基金、中国博士后科学基金、重庆市杰出青年科学基金等多个项目的鼎力支持。
文章链接:
https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(25)00551-9?_returnURL=https%3A%2F%2Flinkinghub.elsevier.com%2Fretrieve%2Fpii%2FS1525001625005519%3Fshowall%3Dtrue
